a cura di Riccardo Marconcini e Marco Palla
Cos'è BRAF e come funziona
BRAF è un importante enzima (chinasi) che controlla la proliferazione cellulare. In particolare, B-RAF è una serin/treonin protein-chinasi appartenente alla famiglia delle proteine RAF che comprende anche altre due isoforme: A-RAF e C-RAF. Tutte esse partecipano alla cascata di traduzione del segnale RAS-RAF-MEK-ERK, nota anche come Mitogen-Activated Protein Kinase (MAPK) pathway, (Ghosh et al.,2009)
Il legame del ligando in maniera specifica ed appropriata al recettore tirosin-chinasico a monte della cascata, porta ad una autofosforilazione del recettore stesso ed alla induzione dell’interazione con la proteina RAS. Ciò porta alla successiva attivazione della proteina RAS, appartenente alla famiglia delle proteine ad attività GPTasica, che passa alternativamente - ed in risposta appunto ai diversi segnali stimolatori - dalla sua forma inattiva a quella attiva. Dopo essere stata attivata, la proteina RAS fosforila RAF che a sua volta lega e fosforila MEK. Questa cascata di attivazione di chinasi localizzate più a valle culmina con la fosforilazione di ERK la quale trasloca nel nucleo dove fosforila specifici fattori di trascrizione che, a loro volta, attivano l’espressione genica.
Il MAPK pathway ha un ruolo importante nelle cellule normali. Infatti, quando indotto in condizioni fisiologiche, da avvio a processi di fosforilazione a cascata delle differenti chinasi che si conclude con la crescita cellulare e la differenziazione. Allo scopo di prevenire l’attivazione persistente del MAPK pathway, viene inviato a monte di tale cascata un feedback negativo. Nelle cellule tumorali che presentano la mutazione del gene BRAF, il processo di attivazione della MAPK pathway è differente, infatti l’assenza del fisiologico feedback negativo induce una permanente attivazione della cascata che porta ad una proliferazione cellulare incontrollata (per semplificare: quando mutato, BRAF si comporta come un interruttore sempre acceso in grado di stimolare continuamente la proliferazione cellulare, diversamente da quanto avviene nelle condizioni fisiologiche in cui esso va incontro ad accensione e spegnimento sulla base dei segnali di attivazione od inattivazione che riceve).
Sebbene tutte e tre le isoforme (A-RAF, B-RAF e C-RAF) siano in grado di attivare la cascata delle MAP chinasi, la isoforma B-RAF ha destato maggiore interesse per la notevole incidenza di mutazioni. Le mutazioni di C-RAF ed A-RAF sono invece rare; inoltre, per la loro attivazione oncogenica, è necessaria la concomitante presenza di due mutazioni.
Mutazioni di BRAF e loro frequenza
Più dell'80% di mutazioni nel gene BRAF sono state evidenziate con diversa frequenza nei vari tipi di tumore; in particolare, il 67% di esse sono state descritte nei melanomi, mentre il rimante 30% in altri tumori, come il cancro della tiroide (15%), il cancro del polmone (3%) ed il tumore del colon-retto (12%).
Circa il 50% dei melanomi presentano mutazioni attivanti BRAF. Tra le mutazioni BRAF osservate nel melanoma, oltre il 90% sono localizzate nel codone 600, e tra queste, oltre il 90% è una mutazione di un singolo nucleotide che risulta nella sostituzione di un residuo di valina con uno di acido glutammico (BRAFV600E: nucleotide 1799 T> A; codone GTG> GAG). La seconda più comune mutazione è BRAFV600K (GTG> AAG), in cui la valina è sostituita dalla lisina, che rappresenta il 5-6%, seguito da BRAFV600R (GTG> AGG), un infrequente doppia variazione nucleotidica della mutazione predominante, BRAF V600 'E2' (GTG> GAA) e BRAF V600D (GTG> GAT) [6]. La prevalenza di BRAFV600K è stata segnalata come superiore in alcune popolazioni [7].
Nel melanoma, la mutazione BRAF è più comune nei pazienti giovani, in aree cutanee esposte in maniera intermittente al sole e senza segni di fotodanneggiamento da esposizione cronica mentre è più rara nei melanomi acrali e mucosali.
Impatto prognostico: che differenza c'è in termini di andamento clinico tra un melanoma BRAF mutato e non mutato?
Per molto tempo si è dibattuto sul valore prognostico della mutazione di BRAF, ovvero se la presenza della mutazione di BRAF individuasse un gruppo di pazienti con andamento clinico peggiore e caratterizzato da minor sopravvivenza. L’introduzione nella pratica clinica di farmaci a bersaglio molecolare (targeted therapy) diretti contro la mutazione di BRAF e capaci di migliorare notevolmente la sopravvivenza di questi pazienti ha complicato la capacità di analisi riguardo a questa specifica domanda.
Una recente metanalisi ha raccolto e analizzato studi che indagavano questo quesito in epoca precedente l’avvento dei farmaci BRAF inibitori: si è visto che il gruppo di pazienti che presentavano la mutazione di BRAFV600 nelle lesioni metastatiche di melanoma presentavano un andamento clinico peggiore e una sopravvivenza minore rispetto ai pazienti con assenza di mutazione nel gene BRAF (Gholamreza Safee Ardekani et al, PlosONE 2012).
Impatto predittivo: quali sono i trattamenti che si possono fare nel paziente BRAF mutato e non mutato e cosa ci aspettiamo da essi
La presenza della mutazione BRAFV600 permette di utilizzare farmaci diretti contro la proteina BRAF mutata e contro la proteina MEK, a valle della cascata, a sua volta attivata in maniera aberrante dalla costitutiva induzione oncogenica di BRAF mutato. Le proteine BRAF mutato e MEK possono essere bersagli specifici di farmaci diretti contro di essi e volti ad inibirne l’attività, causando una interruzione della proliferazione delle cellule di melanoma.
Questi farmaci si definiscono BRAF inibitori (BRAFi) e MEK inibitori (MEKi). Sulla base degli studi degli anni recenti, è stato ampiamente dimostrato che il trattamento dei pazienti affetti da melanoma BRAF mutato con la combinazione di BRAFi e MEKi è significativamente superiore in termini di efficacia e attività rispetto al trattamento con BRAFi somministarto in monoterapia. Esistono attualmente 3 diverse combinazini di BRAFi e MEKi: Vemurafenib e Cobimetinib, Dabrafenib e Trametinib (queste due coppie di BRAFi e MEKii sono attualmente disponibili in commercio in Italia), Encorafenib e Binimetinib (attualmente non disponibili in commercio).
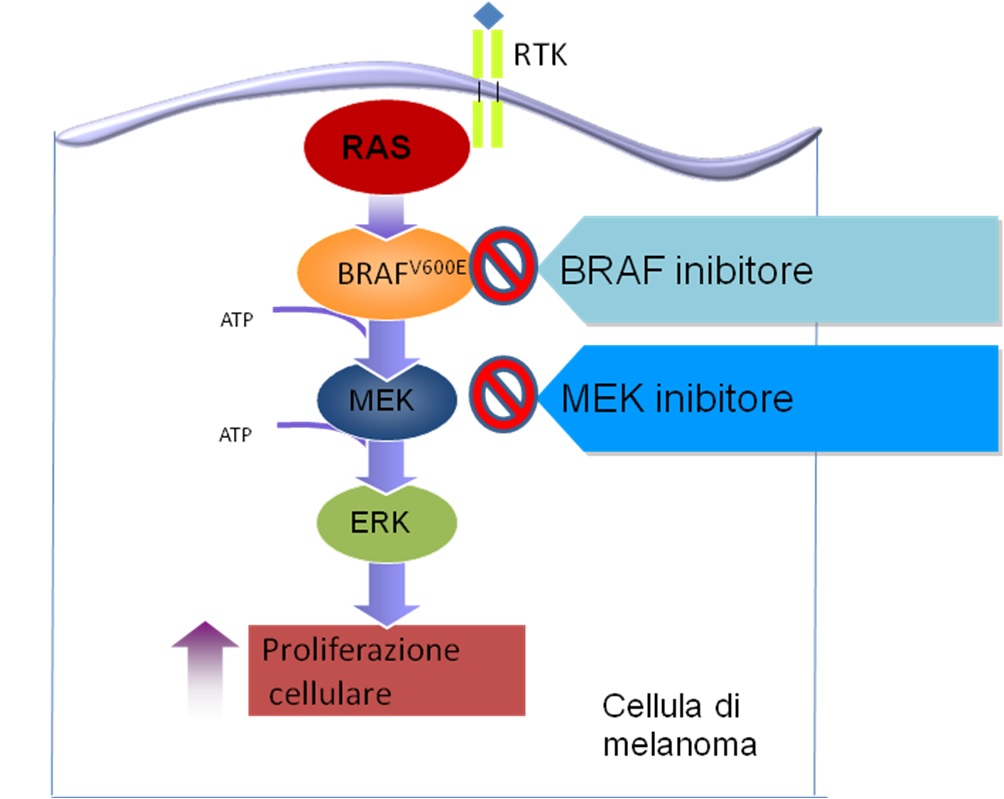
Figura-MAP Kinasi pathway e meccanismo di azione di BRAf e MEK inibitori (vedi testo).
Queste coppie di farmaci si differenziano per la schedula di somministrazione, la posologia, e lo spettro di reazioni avverse previste; tuttavia, dal punto di vista dell’efficacia risultano alquanto sovrapponibili (i dati maggiori presenti in letteratura sono relativi a Vemurafenib+Cobimetinib e Dabrafenib+Trametinib). Tutti i farmaci BRAFe MEK inibitori prevedono assunzione orale:
- Vemurafenib va assunto al dosaggio di 960 mg (4 compresse da 240mg) due volte al giorno tutti i giorni, Cobimetinib al dosaggio di 60 mg (3 compresse da 20mg) per i giorni 1-21 ogni 28 giorni, indipendentemente dai pasti.Come effetti collaterali tipici si riscontrano la fotosensibilità (la maggiore facilità ad ustionarsi se esposti al sole) e la diarrea.
- Dabrafenib si assume al dosaggio di 150 mg (2 compresse da 75mg) 2 volte al giorno, Trametinib al dosaggio di 2 mg (1 compressa da 2mg) al giorno tutti i giorni, lontano dai pasti, conservando trametinib in frigorifero a 4 ° centigradi; l’evento avverso più frequentemente associato all’assunzione di Dabrafenib e Trametinib è il rialzo febbrile sopra i 38 °C.
Dal punto di vista degli eventi avversi, il trattamento di combinazione è generalmente associato ad un minor rischio di sviluppare lesioni squamose iperproliferative (es. carcinomi squamocellulari) e altre tossicità cutanee (incluse ipercheratosi, papillomi cutanee, sindromi mano-piede, alopecia, nonché nuovi melanomi primari).
I trattamenti con BRAFi e MEKi hanno dimostrato di determinare una riduzione delle lesioni tumorali di melanoma in circa il 70% dei casi, con un tempo libero dalla progressione della malattia (ovvero ripresa della crescita delle lesioni inizialmente in risposta o comparsa di nuove lesioni tumorali) mediana di circa 13 mesi. In molteplici studi, si è visto che, tra i pazienti che al momento della diagnosi di localizzazioni metastatiche di melanomanon hanno mai ricevuto trattamenti per il melanoma metastatico, quelli che presentano i migliori indici di efficacia clinica al trattamento con BRAFi e MEKi sono coloro che hanno meno di tre siti metastatici, hanno ottime condizioni generali ed hanno un valore ematico di LDH (lattico deidrogenasi, un enzima coinvolto nel metabolismo cellulare e correlato alla prognosi del melanoma) entro i valori della norma.
In assenza della mutazione di BRAFV600, i farmaci BRAFi e MEKi non trovano indicazione perché quando la mutazione di BRAF non è presente la via di controllo della proliferazione cellulare dipendente da BRAF non è costitutivamente attivata, e non rappresenta quindi un bersaglio per tali farmaci.
Nei pazienti con melanoma metastatico non suscettibile di trattamenti locali che presentano la mutazione di BRAFV600 l’oncologo valuterà in base alle caratteristiche della malattia, alla distribuzione delle lesioni, alla sintomatologia riferita dal paziente e alle sue condizioni generali se intraprendere in prima battuta la targeted therapy con BRAFi e MEKi o se intraprendere il trattamento con farmaci immunomodulanti. Sono in corso ricerche sperimentali volte a comprendere quale strategia sequenziale sia la migliore da attuare, oppure se le somministrazioni in sequenza delle diverse categorie di farmaci possano costituire una opzione migliore.
Nei pazienti con melanoma metastatico non suscettibile di trattamenti locali con assenza di mutazione di BRAF, non sussistendo l’indicazione a trattamento con targeted therapy, verrà intrapreso trattamento con farmaci immunomodulanti.
Mutazioni rare di BRAF (non V600): come possono essere trattate?
Esistono rari casi in cui il gene di BRAF presenti una mutazione differente dalla tipica mutazione V600, in grado comunque di determinare una iperattivazione della proteina BRAFe MEK. Non ci sono studi dedicati in questa popolazione rara ed eterogenea, ma singoli casi clinici riportati aneddoticamente in letteratura che dimostrano come l’utilizzo di BRAF inibitori associati a MEK inibitori, oppure la somministrazione dei soli MEK inibitori comporti una adeguata efficacia, con controllo di malattia in maniera alquanto soddisfacente. L’esiguità dei dati a disposizione e la rarità di queste condizioni non permettono di trarre indicazioni assolute ma pongono le basi per sospettare una probabile efficacia di tali farmaci in questo gruppo di pazienti. Anche in questo caso, comunque, i trattamenti immunomodulanti trovano una reale indicazione all’utilizzo.

