a cura di Elena Marra e Simone Ribero
Negli ultimi anni abbiamo appreso che l'immunoterapia basata sull’impiego degli inibitori dei checkpoint immunologici (immune checkpoint inhibitors; ICI) può offrire un beneficio a lungo termine ai pazienti neoplastici, tale terapia è attiva indipendentemente dall'istologia del tumore e, a fronte di un’attenta considerazione dei profili di tossicità, può essere utilizzata in combinazione con altri trattamenti antitumorali (ad esempio, terapia a bersaglio molecolare, chemioterapia, radioterapia). Più di recente, la ricerca ha dimostrato che l'immunoterapia con ICI può essere utilizzata come terapia adiuvante, che i risultati possono essere influenzati dalla dose e che l'attività clinica è osservata anche in pazienti con metastasi cerebrali.
I checkpoint immunologici, bersaglio degli ICI, funzionano come parte di un complesso sistema di autoregolazione che normalmente impedisce il verificarsi di reazioni autoimmuni. In particolare, due recettori sono stati finora meglio descritti per il loro ruolo in questo sistema di regolazione immunitaria: CTLA-4 e PD-1. I recettori CTLA-4 e PD-1 sono regolatori negativi della funzione immunitaria delle cellule T; l’inibizione di questi bersagli determina di conseguenza l’aumento dell'attivazione del sistema immunitario. La regolazione della risposta immunitaria delle cellule T avviene attraverso il recettore CTLA-4, principalmente negli organi linfoidi, ed attraverso il recettore PD-1, principalmente all'interno dei tessuti periferici e nel microambiente tumorale.
Gli eventi avversi che si verificano con l’utilizzo degli inibitori dei recettori CTLA-4 e PD-1 si manifestano principalmente a livello cutaneo, gastrointestinale, epatico e del sistema endocrino, includendo prurito, rash, nausea, diarrea e tiroiditi. Questi ultimi eventi sono più frequentemente associati al trattamento con anticorpi anti-PD-1 (pembrolizumab e nivolumab), mentre la colite e l'ipofisite con gli anticorpi anti-CTLA-4 (ipilimumab).
Tossicità da anticorpi anti-CTLA-4
Durante la terapia con ipilimumab, alla dose di 3 mg/kg ogni 3 settimane, gli eventi avversi correlate al trattamento immunitario (immune-related adverse events; irAE) si verificano in circa il 60-65% dei pazienti. 1,2 Tali eventi avversi sono per lo più di grado 1 o grado 2 e riguardano principalmente la cute (nel 43-45% dei pazienti) ed il tratto gastrointestinale (nel 29-32% dei pazienti), seguiti dal tessuto epatico e dal sistema endocrino (nel 6-8% di pazienti). 1,2 L’insorgenza è in genere entro 12 settimane dalla somministrazione iniziale. Il tempo mediano di risoluzione degli irAE di grado 2-4 è di 4/6 settimane. Il 5-15% dei pazienti possono sviluppare eventi avversi anche 2 anni dopo il trattamento iniziale. 1,2,3
Tratto gastroenterico
Circa un terzo dei pazienti presenta diarrea “acquosa” di qualsiasi grado; 5,15,16 La diarrea di grado 3 è l'evento avverso più frequente che porta all'interruzione del trattamento da parte dei pazienti che assumono ipilimumab. 1,4,5,6
L'enterocolite indotta da ipilimumab si manifesta nel 8-22% dei pazienti ed è una forma particolare di malattia infiammatoria dell'intestino con caratteristiche di colite ulcerosa e malattia di Crohn. Nella pratica clinica è raccomandata l’esecuzione di sigmoidoscopia o colonscopia in pazienti con diarrea grave (grado ≥ 2). 7
Manifestazioni extra-intestinali come l'artralgia sono osservate fino a un quarto dei pazienti con enterocolite indotta da ipilimumab. 6 Le indagini endoscopiche rivelano eritema, friabilità della mucosa o ulcerazione, prevalentemente nel colon distale. Le caratteristiche istologiche della colite da ipilimumab comprendono: l'infiammazione neutrofilica (nel 46% dei pazienti), l'infiltrazione linfocitaria (nel 15% dei pazienti) o l'infiammazione neutrofila e linfocitaria (nel 38% dei pazienti). 8 Nel 25% dei pazienti, l’infiltrazione della lamina propria del colon con neutrofili, plasmacellule e linfociti avviene 1-2 settimane dopo la prima infusione di ipilimumab. 9 Il trattamento con ipilimumab induce un aumento dei livelli di calprotectina fecale e dei titoli anticorpali alla flora microbica, sebbene questi cambiamenti non siano predittivi della colite. 9
Una risposta ai corticosteroidi si verifica dopo un periodo medio di 16 giorni. I pazienti con colite severa, resistente ai corticosteroidi, non perforata, devono essere trattati con infliximab a causa del rischio di perforazione intestinale. 8
Occasionalmente si possono sviluppare: gastrite ischemica, perforazione gastrointestinale, pancreatite ed epatite. 4,10,11,12,13
Cute
La pelle è coinvolta nel 43-45% dei pazienti: rash e prurito sono gli eventi più comunemente osservati, seguiti dalla vitiligine. 1,2,10 L’eruzione puo essere di tipo eritemato-edematoso o maculopapulare, mentre le sedi più colpite sono tronco ed estremità. Istologicamente, l’infiltrato perivascolare linfocitario (linfociti T CD4+ e CD8+) ed eosinofilo si estende nel derma superficiale e nell'epidermide.
Il trattamento è sintomatico con emollienti, antistaminici e corticosteroidi topici.
La vitiligine si manifesta tipicamente a livello dei nevi, suggerendo una reazione infiammatoria specifica contro i melanociti. 10
Rara è la sindrome di Stevens-Johnson e la necrolisi epidermica tossica, con vasculite leucocitoclastica, pioderma gangrenoso e reazione farmacologica con eosinofilia e sintomi sistemici (Drug Reaction with Eosinophilia and Systemic Symptoms; DRESS). 2,4,10,11,12,13
Sistema endocrino
L'ipofisite si manifesta nel 6-8% dei pazienti e si presenta come panipopituitarismo o deficit dell'ormone pituitario anteriore isolato. 4 I sintomi comprendono affaticamento, mal di testa, vertigini, difficoltà di memoria e disturbi visivi. Quando si sospetta una endocrinopatia immuno-correlata, è necessario un controllo completo per determinare lo stato funzionale dell'ipofisi, della tiroide, delle ghiandole surrenali e delle gonadi. 14 La risonanza magnetica cerebrale con imaging ipofisario può valutare l'ingrandimento della ghiandola, che precede talvolta i sintomi di ipofisite, o la presenza di caratteristiche morfologiche eterogenee della ghiandola pituitaria stessa.
Altri eventi avversi
Sono stati documentati casi di tossicità neurologica compresa la sindrome di Guillain-Barre, meningo-radiculo-neurite, infiammazione granulomatosa del sistema nervoso centrale e meningite asettica, tossicità oculare compresa episclerite e uveite, tossicità respiratoria inclusa sindrome da distress respiratorio acuto fatale, alveolite, granulomatosi polmonare e sarcoidosi, polimiosite autoimmune e citopenia immune. 4,10,11,12,13
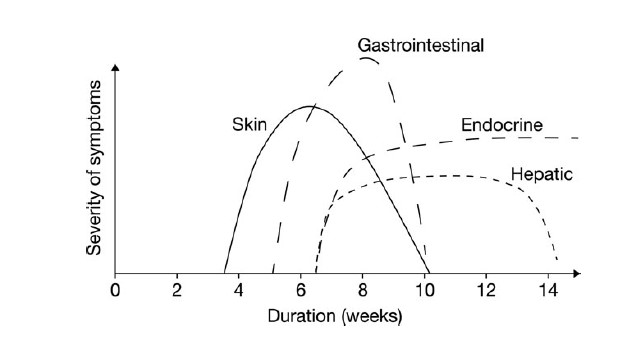
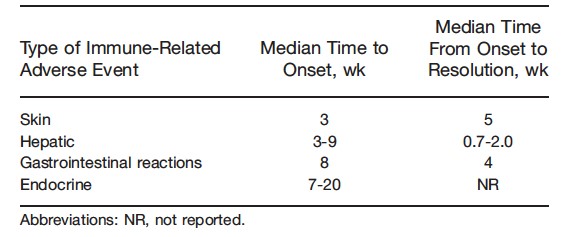
Figura 1: comparsa e durata di eventi avversi a ipilimumab (tratta da reference 3)
Tossicità da anticorpi anti-PD-1
Il trattamento con anticorpi anti-PD-1 comporta il manifestarsi di un minor numero di irAE rispetto al trattamento con ipilimumab. 15,16,17,18,19
Nivolumab e pembrolizumab hanno profili di sicurezza molto simili, a causa dell’analogo meccanismo d’azione, e la somministrazione precedente di ipilimumab non sembra aumentare il rischio di effetti tossici. 19
Pembrolizumab e nivolumab
Complessivamente, gli eventi avversi di ogni grado si sono verificati nel 79-82% dei pazienti (il 14% dei pazienti aveva irAE di grado 3 o 4). 20
Tra gli eventi avversi, risultano principalmente coinvolti: la cute ed i sistemi muscolo-scheletrico, endocrino e gastrointestinale. Gli eventi avversi più comuni includono affaticamento (nel 30-35% dei pazienti), prurito (nel 21-23%), eruzione cutanea (nel 18-26%) e diarrea (nel 13-20% ), tutti di basso grado in più dell’85% dei pazienti
Gli eventi avversi di grado 3-4, chesi verificano nel 12-16% dei pazienti, 20 sono rappresentati nel 3% dei casi da affaticamento, nel 2 % da rash cutanei, nel 1% da tiroidite, ipofisite, insufficienza surrenalica, polmonite, pancreatite, colite, epatite autoimmune e insufficienza renale. 18,19 Solo l'8% dei pazienti ha interrotto il trattamento a causa degli eventi avversi; tra questi: diarrea e colite (rispettivamente nel 2% e nell'1% dei pazienti trattati con nivolumab).
La gestione di questi eventi avversi prevede l’uso di glucocorticoidi e l'interruzione permanente del trattamento. 19
Noto evento avverso è l’ipotiroidismo, preceduto, seppur non sempre, da una tireotossicosi transitoria, con positività agli anticorpi antitiroidei. La tireotossicosi si risolve spontaneamente in circa 4 settimane. 21
Solo un caso di decesso è stato segnalato a causa della neutropenia.
Il tempo mediano di insorgenza degli eventi avversi varia da 5 settimane, per eventi avversi correlati alla pelle, a 15 settimane, per eventi avversi correlati al rene. In totale, l'85% degli eventi avversi si verifica nelle prime 16 settimane di trattamento. 22
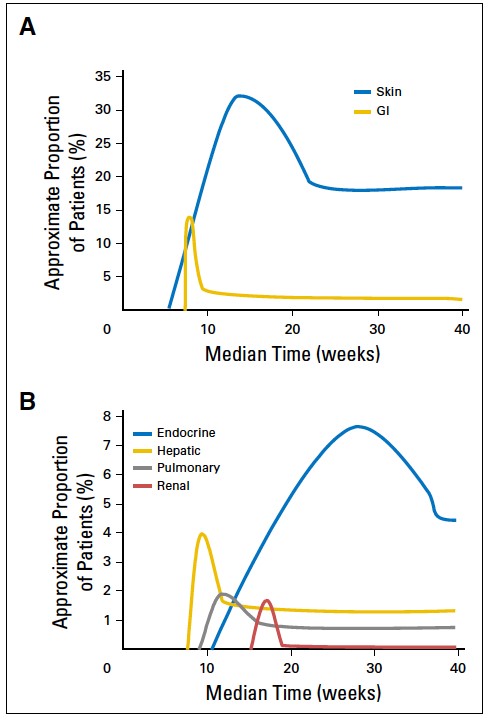
Figura 2: cinetica di comparsa e risoluzione degli AE più comuni (A) e meno comuni (meno del 10 %) (B)(tratta da ref 22)
Tossicità della terapia combinata
Come atteso l’uso combinato di questi due farmaci ha manifestato una maggiore incidenza e uno spettro più ampio di eventi avversi.
Nella terapia combinata fino al 96% dei pazienti sviluppano eventi avversi tra i più comuni rash (55%), prurito (47%), affaticamento (38%), diarrea (34%), nausea (21%) e piressia (21%). 23,24 Gli eventi avversi correlati al trattamento di grado 3-4 sono stati riportati nel 53% dei pazienti. Livelli elevati di lipasi (13%), aspartato aminotransferasi (13%) e alanina aminotransferasi (11%) sono stati gli eventi avversi di grado 3-4 più comuni, indicando rispettivamente effetti tossici sul pancreas e sul fegato.
Gestione
Le linee guida generali sulla gestione degli irAE raccomandano il trattamento dei sintomi; i corticosteroidi sono generalmente indicati insieme alla sospensione del farmaco nei pazienti con eventi avversi persistenti di grado ≥2
Per la gestione di eventi avversi specifici, oltre a un valido gruppo di lavoro che comprende diversi specialisti, quali un gastroenterologo, un epatologo, un endocrinologo, un neurologo o un dermatologo, risulta fondamentale l'educazione del paziente stesso. È necessario mantenere una stretta comunicazione con i pazienti, i quali dovrebbero essere istruiti a chiamare il proprio team di gestione e dovrebbero essere incoraggiati a cercare aiuto ai primi segni o sintomi di un evento avverso.
In generale, gli eventi avversi di grado 1-2 che non interferiscono con le attività della vita quotidiana, sono gestiti con farmaci sintomatici e di solito non richiedono la sospensione della dose. L'interruzione del trattamento è raccomandata per coloro che hanno eventi avversi di grado 3-4 o con eventi avversi persistenti di grado 2. I corticosteroidi sono generalmente indicati in pazienti con eventi avversi persistenti di grado 2 o più gravi, ma l'indicazione esatta e la dose dipendono dal tipo di irAE; generalmente prescritti a dosi medio-alte (da 0,5 a 1 mg / kg di prednisone) e devono essere proseguiti fino alla risoluzione dei sintomi, dopo di che le dosi possono essere ridotte fino al mese successivo al termine del trattamento. 4
Disturbi della pelle
Rash e prurito possono essere ben gestiti usando creme emollienti, antistaminici e / o glucocorticoidi topici e di solito non richiedono l'interruzione del trattamento. Una grave eruzione cutanea come la Sindrome di Lyell (grado 3-4) richiede l’interruzione permanente del trattamento. I corticosteroidi sistemici, come il prednisone, devono essere iniziati alla dose di 1-2 mg / kg / die o equivalenti, con riduzione graduale delle dosi per almeno un mese.
Disordini gastrointestinali
La diarrea di grado 1-2 (definita come meno di quattro scariche al giorno) può essere gestita con agenti antidiarroici come loperamide e / o idratazione orale. Nei pazienti con diarrea persistente o di grado 2, (definita da quattro a sei scariche al giorno) con o senza dolore addominale e muco o sangue nelle feci, è consigliabile eseguire una sigmoidoscopia o una colonscopia. Vanno escluse altre cause di enterocolite, come l'ischemia e / o l'infezione, utilizzando un test delle feci per il citomegalovirus virale, i patogeni batterici e le tossine del Clostridium difficile. Nei pazienti con tali sintomi, gli inibitori del checkpoint immunitario devono essere temporaneamente sospesi e i corticosteroidi orali devono essere iniziati alla dose di 0,5 mg / kg al giorno di prednisone se i sintomi persistono per più di 1 settimana. I pazienti con diarrea di grado 3-4 o colite (definita come sette scariche o più al giorno, sintomi peritoneali e / o dolore addominale grave), devono essere ospedalizzati e gli inibitori del checkpoint immunitario devono essere sospesi definitivamente. Una sigmoidoscopia è obbligatoria per verificare la presenza di eritema o ulcerazione. Devono essere prescritti anche il reintegro di liquidi ed elettroliti e il metilprednisolone per via endovenosa. Si raccomanda di monitorare la risposta al trattamento utilizzando il punteggio di Lichtiger, originariamente concepito per monitorare le risposte dei pazienti sottoposti a trattamento per la colite ulcerosa grave. 25. Se i sintomi dei pazienti non migliorano significativamente dopo 5 giorni di corticosteroidi per via endovenosa, il trattamento con 5 mg / kg di dosi di anticorpi anti-TNF infliximab deve essere iniziato. 26,27,28 I pazienti che ricevono un trattamento con infliximab devono essere attentamente monitorati per il rischio di perforazione intestinale e nel sospetto è fondamentale richiedere una consulenza chirurgica.
Disturbi endocrini
Bisogna prestare attenzione ai pazienti che sviluppano endocrinopatie dopo il trattamento con inibitori del checkpoint, compresi tiroidite, ipofisite e insufficienza surrenalica 4. La tiroidite è spesso indolore e asintomatica. Se si verifica ipertiroidismo, deve essere iniziato un trattamento sintomatico con β-bloccanti e ansiolitici. Non sono necessari farmaci antitiroidei, tranne nel caso di diagnosi di malattia di Graves. I corticosteroidi non sembrano fornire benefici. L'ipertiroidismo si risolve spontaneamente ed evolve in ipotiroidismo, quest’ultimo deve essere trattato con la terapia ormonale sostitutiva. L'ipofisite provoca tipicamente bassi livelli plasmatici sia dell’ormone adrenocorticotropo (ACTH) che del cortisolo, mentre l’insufficienza surrenalica si traduce in bassi livelli plasmatici di cortisolo e un normale ACTH. Allo stesso modo, l'ipofisite provoca bassi livelli di tiroxina libera (T4), triiodotironina libera (T3) e ormone stimolante la tiroide (TSH); mentre la tiroidite periferica che porta all'ipotiroidismo causa un aumento dei livelli di TSH e bassi livelli di T3 e T4 liberi. In caso di sospetto di ipofisite, la terapia ormonale sostitutiva (HRT) deve essere iniziata senza attendere la diagnosi confermata per evitare un rapido peggioramento dei sintomi. Le endocrinopatie correlate al trattamento hanno un alto rischio di essere irreversibili; sebbene, generalmente, i sintomi correlati si risolvano con l'uso di una HRT adattata e il trattamento con inibitori del checkpoint può essere continuato o ripreso in pazienti che ricevono dosi stabili di TOS. L'uso di steroidi sistemici non è necessario, eccetto in presenza di sintomi di ipofisite con effetto di massa; in questo caso, deve essere somministrata una dose iniziale per via endovenosa di metilprednisone di 1-2 mg / kg seguita da prednisone orale giornaliero di 1-2 mg / kg con graduale scalare della dose in 4 settimane e adattato a HRT 4
I pazienti che hanno una crisi surrenale possono avere grave e rapida disidratazione, ipotensione o shock, per i quali è richiesto il ricovero immediato. I corticosteroidi per via endovenosa con attività mineralcorticoide devono essere iniziati, escludendo la presenza di sepsi o infezione.
Attualmente non sono disponibili linee guida convalidate sulla frequenza del monitoraggio dei livelli ormonali. I livelli di TSH, ACTH e cortisolo devono essere misurati al basale e ogni volta che si osserva un sintomo suggestivo. In base all’esperienza clinica sarebbe opportuno un controllo sistematico di questi livelli ormonali ogni mese per i primi 3 mesi di trattamento, e successivamente ogni 2 mesi.
Altri sintomi
Nei pazienti con patologie autoimmuni preesistenti, non è ancora stato stabilito se gli irAE o le riacutizzazioni di disordini autoimmuni si verificano ad un tasso più elevato. Tuttavia sembra associarsi un peggioramento sintomatico o un'esacerbazione di patologie autoimmuni preesistenti nel 50% dei pazienti 29. Tutti i sintomi si sono risolti con brevi cicli di corticosteroidi e nessuno dei pazienti ha richiesto un'ulteriore immunosoppressione. Di conseguenza, i medici che prevedono l'uso di inibitori del checkpoint immunitario in questi pazienti devono monitorare il potenziale rischio di esacerbazione di eventuali patologie autoimmuni preesistenti.
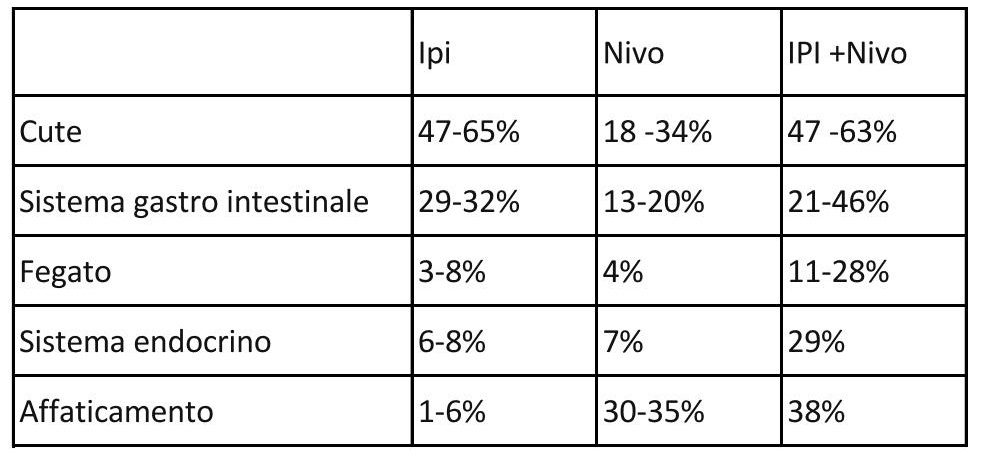
Tabella 1: percentuale di pazienti che sviluppano eventi avversi a seconda delle differenti terapie

