 A metà giugno sono stati finalmente pubblicati, sulla prestigiosa rivista scientifica Lancet, i primi risultati dello studio IMspire150, trial di fase III randomizzato, volto a valutare l’efficacia di atezolizumab, vemurafenib e cobimetinib come trattamento di prima linea nei pazienti con diagnosi di melanoma BRAF V600 mutato, avanzato non resecabile o metastatico.
A metà giugno sono stati finalmente pubblicati, sulla prestigiosa rivista scientifica Lancet, i primi risultati dello studio IMspire150, trial di fase III randomizzato, volto a valutare l’efficacia di atezolizumab, vemurafenib e cobimetinib come trattamento di prima linea nei pazienti con diagnosi di melanoma BRAF V600 mutato, avanzato non resecabile o metastatico.
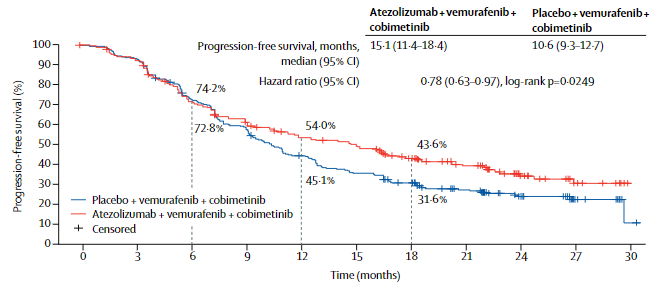
Il disegno dello studio prevedeva due bracci di trattamento con randomizzazione 1:1 in doppio cieco: un braccio di tripla combinazione con atezolizumab, vamurafenib e cobimetinib, e un braccio di confronto con vemurafenib, cobimetinib e placebo. L’endpoint primario era la Progression Free Survival (PFS).
Un totale di 514 pazienti è stato arruolato tra il gennaio 2017 e l’aprile 2018 in 112 centri in 20 paesi: tra questi, 256 pazienti hanno ricevuto il trattamento con la tripla combinazione, mentre 258 pazienti hanno ricevuto vemurafenib, cobimetinib e placebo. Il data cutoff è avvenuto a Ottobre 2019, con un follow up mediano di 18.9 mesi.
L’aggiunta di atezolizumab a vemurafenib e cobimetinib ha significativamente prolungato la PFS, sia alla valutazione da parte degli investigatori (15.1 vs 10.6 mesi), sia in una revisione centrale da parte di un comitato di revisori indipendenti (16.1 vs 12.3 mesi), con una riduzione del rischio di progressione o morte del 22%. I tassi di risposta (ORR) sono stati simili nei due gruppi di studio (66.3 e 65%) mentre la durata di risposta mediana è stata superiore nel gruppo con atezolizumab (21 vs 12.6 mesi).
In questa pubblicazione è stata effettuata inoltre una analisi ad interim della sopravvivenza globale (OS) a 2 anni, che è stata stimata essere del 60% nel gruppo con atezolizumab versus il 53% nel gruppo con placebo. Ovviamente, si tratta di dati immaturi e sarà necessario un follow up più lungo per poter confermare o smentire questa proiezione.
Relativamente alla tossicità, gli eventi avversi comuni (rialzo delle CPK, febbre, artralgia, mialgia, rialzo delle transaminasi e della bilirubina, alterazioni della funzionalità tiroidea, polmonite, prurito, edemi periferici) sono stati più frequenti nel gruppo con atezolizumab. Tuttavia, gli eventi avversi di grado 3-4 (rialzo delle CPK, rialzo delle transaminasi, fotosensibilità, nausea e reazioni da infusione) sono stati solo leggermente più frequenti nel braccio con atezolizumab (79% vs 73%). La percentuale di eventi avversi gravi è stata simile nei due bracci di trattamento (33% vs 29%).
In conclusione, possiamo dedurre che l’aggiunta di atezolizumab a vemurafenib e cobimetinib sembra permettere di prolungare risposte normalmente ottenibili con la combinazione target, a fronte di un profilo di tossicità accettabile. Si tratta di un risultato estremamente promettente per le possibilità terapeutiche future, oltre che di un dato fondamentale per la direzione della ricerca scientifica.
https://pubmed.ncbi.nlm.nih.gov/32534646/
